Antwort Kolik je částic v molů? Weitere Antworten – Kolik má jeden mol částic
Mol (značka mol) je základní fyzikální jednotka látkového množství. Jeden mol libovolné látky obsahuje přesně 6,02214076×1023 částic (atomů, molekul, iontů apod.), což je číselná hodnota Avogadrovy konstanty vyjádřené v jednotkách mol−1.Toto číslo se označuje jako Avogadrova konstanta, značí se N A N_A NA. Platí tedy vztah n = N N A n = \frac{N}{N_A} n=NAN, kde n je látkové množství, N A N_A NA je Avogadrova konstanta a N je skutečný počet částic.Klidová hmotnost molekuly je rovna součtu klidových hmotností atomů, které molekulu tvoří. Relativní molekulovou hmotnost můžeme také vyjádřit jako součet relativních atomových hmotností atomů, které tvoří molekulu.

Co je to jeden mol : Jednotkou látkového množství je 1 mol. mol Jeden mol je takové látkové množství, které obsahuje stejný počet částic, jako je počet atomů uhlíku v 12 g nuklidu 12C. Částice musí být vždy specifikována, nejčastěji v závorce za symbolem látkového množství látky, a může jí být molekula, atom, ion, elektron apod.
Co znamená G mol
Molární hmotnost (M) je hmotnost 1 molu látky, např. M(NaOH) = 40 g/mol, M(H2) = 2 g/mol. Molekulová relativní hmotnost má stejnou hodnotu, ale je bez jednotky.
Kolik váží 1 atom : Atomy a molekuly se váží velice špatně. Skutečná hmotnost atomů a molekul je nepředstavitelně malá. Jeden atom uhlíku, který obsahuje šest protonů, šest neutronů a šest elektronů, váží 0,000 000 000 000 000 000 000 000 019 kg (1,9 · 10–26 kg).
Pokud se v molekule nachází více atomů určitého prvku, tento počet se vyjádří arabskou číslicí za značkou prvku v dolním indexu. Např. N2 = dvouatomová molekula dusíku.
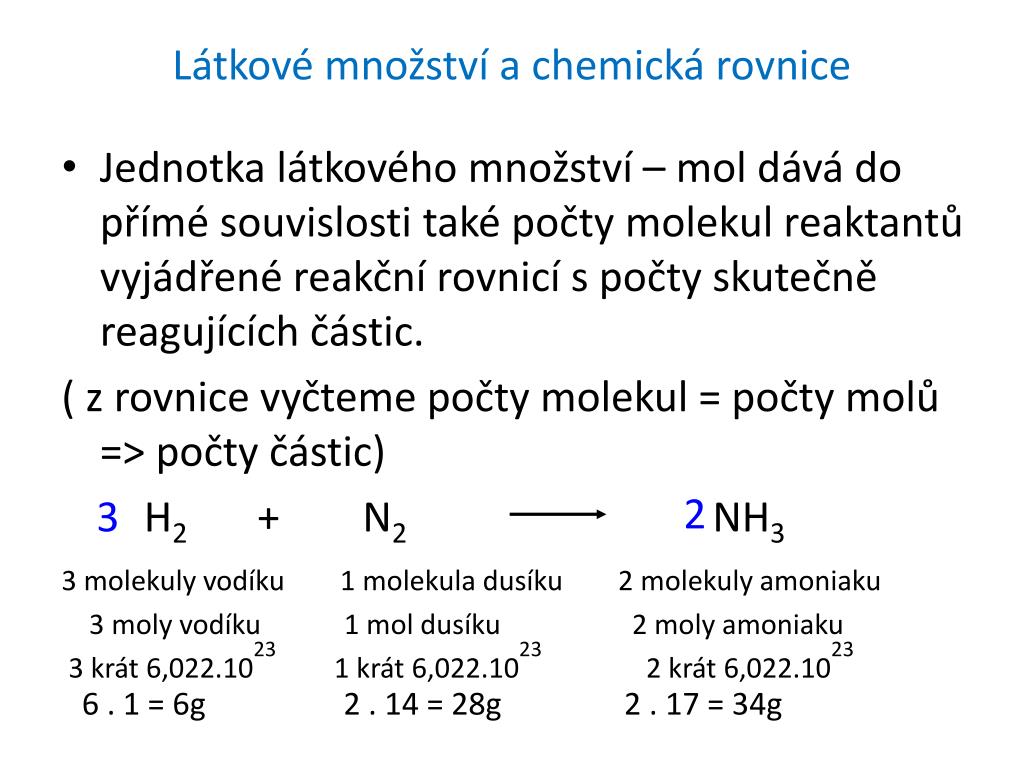
= 6,022⋅1023 N = V 5 molech molekul vody je obsaženo 3,011 . 1024 molekul vody.
Jak zjistit počet atomů v molekule
Více atomů může tvořit molekuly, jejich složení se vyjadřuje chemickým vzorcem. Pokud se v molekule nachází více atomů určitého prvku, tento počet se vyjádří arabskou číslicí za značkou prvku v dolním indexu. Např. N2 = dvouatomová molekula dusíku.Jednotkou látkového množství je mol. 1 mol je množství látky, které obsahuje 6,022 . 1023 částic (molekuly, atomy, n. ionty) = Avogadrova konstanta (ve vzorci značena NA; N je skutečný počet částic v látce).Molární koncentrace (molarita)
Molarita roztoku se někdy zkráceně označuje písmenem M. Např. 2M znamená, že roztok je dvoumolární, tedy s koncentrací 2 mol/dm3.
Molární hmotnost vypočítáme z údajů v periodické soustavě prvků, s její pomocí je výpočet poměrně jednoduchý. Stačí sečíst všechny atomové hmotnosti prvků dané sloučeniny. Pokud je jeden atom ve sloučenině vícekrát (např. v H2O jsou dva atomy vodíku a jeden atom kyslíku), pak jej také do součtu přidáme vícekrát.
Kolik váží 1 mol : Výpočet. ≈ 1×10−3 kg/mol = 1 g/mol dostáváme molární hmotnost: M(H) = 1,007 97(7) × 1 g/mol = 1,007 97(7) g/mol.
Jak velký je jeden atom : Většina objemu atomu je "prázdná", podobně jako je prázdná většina meziplanetárního prostoru. Rozměry atomu jsou nepatrné, přibližně 10-10 m, tedy jedna desetimilióntina milimetru. Jádro atomu je však ještě mnohem menší – jeho "průměr" je ještě asi stotisíckrát menší, kolem 10-15 m.
Co má atomové číslo 1
S protonovým číslem souvisejí tyto termíny: Tři izotopy vodíku s protonovým číslem 1: * Protium obsahuje jeden proton a jeden elektron * Deuterium jeden proton, jeden neutron a jeden elektron * Tritium jeden proton, dva neutrony a jeden elektron Neutronové číslo (N) – je počet neutronů v jádře atomu.
Chemicky čistá voda je chemická sloučenina skládající se ze dvou atomů vodíku a jednoho atomu kyslíku. Chemicky čistá voda má vzorec H2O a neobsahuje žádné jiné látky.Nejčastěji jsou molekuly definovány jako elektricky neutrální částice složené ze dvou nebo více atomů.
Jak se počítá MR : Obdobně jako u nákladů se rozlišuje i u příjmů mezní hodnota; změna celkového příjmu (TR) vyvolaná změnou výstupu (Q) o jednotku se nazývá mezní příjem (marginal revenue – MR) a vypočítá se: MR = ΔTR/ΔQ.



